Инструкция на Клексан 2000 анти-Ха МЕ/0.2 мл, раствор для инъекций, 0.2 мл, 10 шт.
Состав
| Раствор для инъекций 2000 анти-Xa МЕ/0,2 мл; 4000 анти-Xa МЕ/0,4 мл; 6000 анти-Xa МЕ/0,6 мл; 8000 анти-Xa МЕ/0,8 мл; 10000 анти-Xa МЕ/1 мл |
| В шприце | Предварительно заполненные шприцы | ||||
| 2000 анти-Xa МЕ/0,2 мл | 4000 анти-Xa МЕ/0,4 мл | 6000 анти-Xa МЕ/0,6 мл | 8000 анти-Xa МЕ/0,8 мл | 10000 анти-Xa МЕ/1,0 мл | |
| Активное вещество: эноксапарин натрия (Евр.Ф., НД фирмы) | 20 мг* | 40 мг* | 60 мг* | 80 мг* | 100 мг* |
| Растворитель: вода для инъекций (Евр.Ф.) | до 0,2 мл | до 0,4 мл | до 0,6 мл | до 0,8 мл | до 1,0 мл |
* Масса рассчитана на основании содержания используемого эноксапарина натрия (теоретическая активность 100 анти-Xa МЕ/мг).
Описание
Прозрачный раствор от бесцветного до бледно-желтого цвета.
Фармакодинамика
Эноксапарин натрия — низкомолекулярный гепарин со средней молекулярной массой около 4500 Да: менее 2000 Да — <20%, от 2000 до 8000 дальтон — >68%, более 8000 Да — <18%. Эноксапарин натрия получают щелочным гидролизом бензилового эфира гепарина, выделенного из слизистой оболочки тонкого кишечника свиньи. Его структура характеризуется невосстанавливающимся фрагментом 2-О-сульфо-4-енпиразиносуроновой кислоты и восстанавливающимся фрагментом 2-N,6-О-дисульфо-D-глюкопиранозида. Структура эноксапарина содержит около 20% (в пределах от 15 до 25%) 1,6-ангидропроизводного в восстанавливающемся фрагменте полисахаридной цепи. В очищенной системе in vitro эноксапарин натрия обладает анти-Ха активностью (примерно 100 МЕ/мл) и низкой анти-IIа или антитромбиновой активностью (примерно 28 МЕ/мл).
Эта антикоагулянтная активность действует через антитромбин III (АТ-III), обеспечивая антикоагулянтную активность у людей. Кроме анти-Ха/IIа активности, также выявлены дополнительные антикоагулянтные и противовоспалительные свойства эноксапарина натрия как у здоровых людей и пациентов, так и на моделях животных. Это включает АТ-III-зависимое ингибирование других факторов свертывания — как фактор VIIа, активацию высвобождения ингибитора пути тканевого фактора (ПТФ), а также снижение высвобождения фактора Виллебранда из эндотелия сосудов в кровоток. Эти факторы обеспечивают антикоагулянтный эффект эноксапарину натрия в целом.
При использовании его в профилактических дозах он незначительно изменяет АЧТВ, практически не оказывает воздействия на агрегацию тромбоцитов и на уровень связывания фибриногена с рецепторами тромбоцитов.
Анти-IIa активность в плазме примерно в 10 раз ниже, чем анти-Xа активность. Средняя максимальная анти-IIа активность наблюдается примерно через 3–4 ч после п/к введения и достигает 0,13 и 0,19 МЕ/мл после повторного введения 1 мг/кг — при двукратном введении и 1,5 мг/кг — при однократном введении соответственно.
Средняя максимальная анти-Ха активность плазмы наблюдается через 3–5 ч после п/к введения препарата и составляет примерно 0,2; 0,4; 1,0 и 1,3 анти-Ха МЕ/мл после п/к введения 20, 40 мг и 1 мг/кг и 1,5 мг/кг соответственно.
Фармакокинетика
Фармакокинетика эноксапарина в указанных режимах дозирования носит линейный характер. Вариабельность внутри и между группами пациентов низкая. После повторного п/к введения 40 мг эноксапарина натрия один раз в сутки и п/к введения эноксапарина натрия в дозе 1,5 мг/кг один раз в сутки у здоровых добровольцев равновесная концентрация достигается ко 2 дню, причем площадь под фармакокинетической кривой в среднем на 15% выше, чем после однократного введения. После повторных п/к введений эноксапарина натрия в суточной дозе 1 мг/кг два раза в сутки равновесная концентрация достигается через 3–4 дня, причем площадь под фармакокинетической кривой в среднем на 65% выше, чем после однократного введения и средние значения Cmax составляют соответственно 1,2 и 0,52 МЕ/мл.
Биодоступность эноксапарина натрия при п/к введении, оцениваемая на основании анти-Ха активности, близка к 100%.
Объем распределения анти-Ха активности эноксапарина натрия составляет примерно 5 л и приближается к объему крови.
Эноксапарин натрия является препаратом с низким клиренсом. После в/в введения в течение 6 ч в дозе 1,5 мг/кг среднее значение клиренса анти-Ха в плазме составляет 0,74 л/ч.
Выведение препарата носит монофазный характер с T1/2 4 ч (после однократного п/к введения) и 7 ч (после многократного введения препарата).
Эноксапарин натрия в основном метаболизируется в печени путем десульфатирования и/или деполимеризации с образованием низкомолекулярных веществ с очень низкой биологической активностью. Выведение через почки активных фрагментов препарата составляет примерно 10% от введенной дозы и общая экскреция активных и неактивных фрагментов составляет примерно 40% от введенной дозы.
Возможна задержка выведения эноксапарина натрия у пожилых пациентов в результате снижения функции почек с возрастом.
Отмечено уменьшение клиренса эноксапарина натрия у больных со сниженной функцией почек. После повторного п/к введения 40 мг эноксапарина натрия один раз в сутки происходит увеличение активности анти-Ха, представленной площадью под фармакокинетической кривой у больных с незначительным (Cl креатинина 50–80 мл/мин) и умеренным (Cl креатинина 30–50 мл/мин) нарушением функции почек. У больных с тяжелым нарушением функции почек (Cl креатинина <30 мл/мин) площадь под фармакокинетической кривой в состоянии равновесия в среднем на 65% выше при повторном п/к введении 40 мг препарата один раз в сутки.
У людей с избыточной массой тела при п/к введении препарата клиренс несколько меньше. Если не делать поправку дозы с учетом массы тела больного, то после однократного п/к введения 40 мг эноксапарина натрия анти-Ха активность будет на 50% выше у женщин с массой тела менее 45 кг и на 27% выше у мужчин с массой тела менее 57 кг по сравнению с пациентами с обычной средней массой тела.
Клексан: Показания
- профилактика венозных тромбозов и эмболии при хирургических вмешательствах, особенно при ортопедических и общехирургических операциях;
- профилактика венозных тромбозов и эмболии у больных, находящихся на постельном режиме, вследствие острых терапевтических заболеваний, включая острую сердечную недостаточность и декомпенсацию хронической сердечной недостаточности (III или IV класс NYHA), острую дыхательную недостаточность, а также при тяжелых острых инфекциях и острых ревматических заболеваниях в сочетании с одним из факторов риска венозного тромбообразования (см. «Особые указания»);
- лечение тромбоза глубоких вен с тромбоэмболией легочной артерии или без тромбоэмболии легочной артерии;
- профилактика тромбообразования в системе экстракорпорального кровообращения во время гемодиализа (обычно при продолжительности сеанса не более 4 ч);
- лечение нестабильной стенокардии и инфаркта миокарда без зубца Q в сочетании с ацетилсалициловой кислотой;
- лечение острого инфаркта миокарда с подъемом сегмента ST у пациентов, подлежащих медикаментозному лечению или последующему чрескожному коронарному вмешательству.
Способ применения и дозы
- За исключением особых случаев (см. ниже Лечение инфаркта миокарда с подъемом сегмента ST, медикаментозное или с помощью чрескожного коронарного вмешательства и Профилактика тромбообразования в системе экстракорпорального кровообращения при проведении гемодиализа), эноксапарин натрия вводится глубоко п/к. Инъекции желательно проводить в положении больного лежа. При использовании предварительно заполненных шприцев на 20 и 40 мг во избежание потери препарата перед инъекцией не надо удалять пузырьки воздуха из шприца. Инъекции следует проводить поочередно в левую или правую переднелатеральную или заднелатеральную области брюшной стенки. Иглу необходимо вводить вертикально (не сбоку) на всю длину, в кожную складку, собранную и удерживаемую между большим и указательным пальцами. Складку кожи отпускают только после завершения инъекции. Не следует массировать место инъекции после введения препарата.
- Предварительно заполненный одноразовый шприц готов к применению.
- Препарат нельзя вводить в/м.
- Профилактика венозных тромбозов и эмболий при хирургических вмешательствах, особенно при ортопедических и общехирургических операциях
- Пациентам с умеренным риском развития тромбозов и эмболий (например абдоминальные операции) рекомендуемая доза препарата Клексан® составляет 20 или 40 мг 1 раз в сутки п/к. Первую инъекцию следует сделать за 2 ч до хирургического вмешательства.
- Пациентам с высоким риском развития тромбозов и эмболий (например при ортопедических операциях) препарат рекомендуется в дозе 40 мг 1 раз в сутки п/к, с введением первой дозы за 12 ч до хирургического вмешательства, или в дозе 30 мг 2 раза в сутки с началом введения через 12–24 ч после операции.
- Длительность лечения препаратом Клексан® в среднем составляет 7–10 дней. При необходимости терапию можно продолжать до тех пор, пока сохраняется риск развития тромбоза и эмболии и пациент не перейдет на амбулаторный режим. При ортопедических операциях может быть целесообразно после начальной терапии продолжение лечения путем введения препарата Клексан® в дозе 40 мг 1 раз в сутки в течение 3 нед.
- Особенности применения препарата Клексан® при спинальной/ эпидуральной анестезии, а также процедурах коронарной реваскуляризации описаны в разделе «Особые указания».
- Профилактика венозных тромбозов и эмболий у пациентов, находящихся на постельном режиме вследствие острых терапевтических заболеваний
- Рекомендуемая доза препарата Клексан® составляет 40 мг 1 раз в сутки, п/к, как минимум в течение 6 дней. Терапию следует продолжать до полного перехода пациента на амбулаторный режим (максимально в течение 14 дней).
- Лечение тромбоза глубоких вен с тромбоэмболией легочной артерии или без тромбоэмболии легочной артерии
- Препарат вводится п/к из расчета 1,5 мг/кг 1 раз в сутки или 1 мг/кг 2 раза в сутки. У пациентов с осложненными тромбоэмболическими нарушениями препарат рекомендуется применять в дозе 1 мг/кг 2 раза в сутки.
- Длительность лечения в среднем составляет 10 дней. Следует сразу же начать терапию непрямыми антикоагулянтами, при этом лечение препаратом Клексан® необходимо продолжать до достижения терапевтического антикоагулянтного эффекта (значения МНО должны составлять 2–3).
- Профилактика тромбообразования в системе экстракорпорального кровообращения во время гемодиализа
- Рекомендуемая доза препарата Клексан® составляет в среднем 1 мг/кг. При высоком риске развития кровотечения дозу следует снизить до 0,5 мг/кг при двойном сосудистом доступе или до 0,75 мг при одинарном сосудистом доступе.
- При гемодиализе препарат Клексан® следует вводить в артериальный участок шунта в начале сеанса гемодиализа. Одной дозы, как правило, достаточно для 4-часового сеанса, однако при обнаружении фибриновых колец при более продолжительном гемодиализе можно дополнительно ввести препарат из расчета 0,5–1 мг/кг.
- Лечение нестабильной стенокардии и инфаркта миокарда без зубца Q
- Препарат Клексан® вводится из расчета 1 мг/кг каждые 12 ч, п/к, при одновременном применении ацетилсалициловой кислоты в дозе 100–325 мг 1 раз в сутки. Средняя продолжительность терапии составляет как минимум 2 дня и продолжается до стабилизации клинического состояния пациента. Обычно введение препарата продолжается от 2 до 8 дней.
- Лечение острого инфаркта миокарда с подъемом сегмента ST, медикаментозное или с помощью чрескожного коронарного вмешательства
- Лечение начинают с однократного в/в болюсного введения эноксапарина натрия в дозе 30 мг.
- Сразу же после него п/к вводят эноксапарин натрия в дозе 1 мг/кг. Далее препарат назначают п/к по 1 мг/кг каждые 12 ч (максимально 100 мг эноксапарина натрия для каждой из первых двух подкожных инъекций, затем — по 1 мг/кг для оставшихся подкожных доз, т.е. при массе тела более 100 кг разовая доза может превышать 100 мг). У пациентов 75 лет и старше не применяется начальное в/в болюсное введение. Препарат вводят п/к в дозе 0,75 мг/кг каждые 12 ч (максимально 75 мг эноксапарина натрия для каждой из первых двух п/к инъекций, затем — по 0,75 мг/кг для оставшихся п/к доз, т.е. при массе тела более 100 кг разовая доза может превышать 75 мг).
- При комбинации с тромболитиками (фибринспецифическими и фибриннеспецифическими) эноксапарин натрия должен вводиться в интервале от 15 мин до начала тромболитической терапии и до 30 мин после нее. Как можно скорее после выявления острого инфаркта миокарда с подъемом сегмента ST, пациентам необходимо назначить одновременно ацетилсалициловую кислоту, и, если нет противопоказаний, прием ацетилсалициловой кислоты (в дозах 75–325 мг) следует продолжать ежедневно в течение не менее 30 дней.
- Рекомендуемая продолжительность лечения препаратом Клексан® составляет 8 дней или до выписки пациента из стационара (если период госпитализации составляет менее 8 дней). В/в болюсное введение эноксапарина натрия должно проводиться через венозный катетер. Эноксапарин натрия не должен смешиваться или вводиться вместе с другими лекарственными препаратами. Для того, чтобы избежать присутствия в инфузионной системе следов других лекарственных препаратов и их взаимодействия с эноксапарином натрия, венозный катетер должен промываться достаточным количеством 0,9% раствора натрия хлорида или 5% раствора декстрозы до и после в/в болюсного введения эноксапарина натрия. Эноксапарин натрия может безопасно вводиться с 0,9% раствором натрия хлорида и 5% раствором декстрозы.
- Для проведения болюсного введения 30 мг эноксапарина натрия при лечении острого инфаркта миокарда с подъемом сегмента ST из стеклянных шприцев 60, 80 и 100 мг удаляют лишнее количество препарата с тем, чтобы в них оставалось только 30 мг (0,3 мл). Доза 30 мг может непосредственно вводиться в/в.
- Для проведения в/в болюсного введения эноксапарина натрия через венозный катетер могут использоваться предварительно заполненные шприцы для п/к введения препарата 60, 80 и 100 мг. Рекомендуется использовать шприцы 60 мг, т.к. это уменьшает количество удаляемого из шприца препарата. Шприцы 20 мг не используются, т.к. в них недостаточно препарата для болюсного введения 30 мг эноксапарина натрия. Шприцы 40 мг не используются, т.к. на них отсутствуют деления, и поэтому невозможно точно отмерить количество в 30 мг.
- У пациентов, которым проводится чрескожное коронарное вмешательство, в случае, если последняя п/к инъекция эноксапарина натрия была проведена менее чем за 8 ч до раздувания введенного в место сужения коронарной артерии баллонного катетера, дополнительное введение эноксапарина натрия не требуется. Если же последняя п/к инъекция эноксапарина натрия проводилась более чем за 8 ч до раздувания баллонного катетера, следует произвести дополнительное в/в болюсное введение эноксапарина натрия в дозе 0,3 мг/кг.
- Для повышения точности дополнительного в/в болюсного введения малых объемов в венозный катетер при проведении чрескожных коронарных вмешательств рекомендуется развести препарат до концентрации 3 мг/мл.
- Разведение раствора рекомендуется проводить непосредственно перед введением.
- Для получения раствора эноксапарина натрия с концентрацией 3 мг/мл с помощью предварительно заполненного шприца 60 мг рекомендуется использовать емкость с инфузионным раствором 50 мл (т.е. с 0,9% раствором натрия хлорида или 5% раствором декстрозы). Из емкости с инфузионным раствором с помощью обычного шприца извлекается и удаляется 30 мл раствора. Эноксапарин натрия (содержимое шприца для п/к введения 60 мг) вводится в оставшиеся в емкости 20 мл инфузионного раствора. Содержимое емкости с разведенным раствором эноксапарина натрия осторожно перемешивается. Для введения с помощью шприца извлекается необходимый объем разведенного раствора эноксапарина натрия, который рассчитывается по формуле:
- Объем разведенного раствора = Вес пациента (кг) × 0,1; или с помощью представленной ниже таблицы 1.
- Таблица 1
- Объемы, которые должны вводиться внутривенно после разведения
| Вес, кг | Необходимая доза (0,3 мг/кг), мг | Необходимый для введения объем раствора, разведенного до концентрации 3 мг/мл, мл |
| 45 | 13,5 | 4,5 |
| 50 | 15 | 5 |
| 55 | 16,5 | 5,5 |
| 60 | 18 | 6 |
| 65 | 19,5 | 6,5 |
| 70 | 21 | 7 |
| 75 | 22,5 | 7,5 |
| 80 | 24 | 8 |
| 85 | 25,5 | 8,5 |
| 90 | 27 | 9 |
| 95 | 28,5 | 9,5 |
| 100 | 30 | 10 |
- Пациенты пожилого возраста
- За исключением лечения инфаркта миокарда с подъемом сегмента ST (см. выше), для всех других показаний снижения доз эноксапарина натрия у пациентов пожилого возраста, если у них отсутствует нарушение функции почек, не требуется.
- Пациенты с почечной недостаточностью
- Тяжелые нарушения функции почек (Cl креатинина менее 30 мл/мин). Доза эноксапарина натрия снижается в соответствии с представленными ниже таблицами 2 и 3, т.к. у этих пациентов отмечается увеличение системной экспозиции (продолжительности действия) препарата.
- При применении препарата с лечебной целью рекомендуется следующая коррекция режима дозирования.
- Таблица 2
| Обычный режим дозирования | Режим дозирования при тяжелой почечной недостаточности |
| 1 мг/кг п/к 2 раза в сутки | 1 мг/кг п/к 1 раз в сутки |
| 1,5 мг п/к 1 раз в сутки | 1 мг/кг п/к 1 раз в сутки |
| Лечение острого инфаркта миокарда с подъемом сегмента ST у пациентов <75 лет | |
| Однократно: болюсное в/в введение в дозе 30 мг плюс 1 мг/кг п/к; с последующим п/к введением в дозе 1 мг/кг 2 раза в сутки (максимально 100 мг для каждой из двух первых п/к инъекций) | Однократно: болюсное в/в введение в дозе 30 мг плюс 1 мг/кг п/к с последующим п/к введением в дозе 1мг/кг 1 раз в сутки (максимально 100 мг для первой п/к инъекции) |
| Лечение острого инфаркта миокарда с подъемом сегмента ST у пациентов ≥75 лет и старше | |
| 0,75 мг/кг п/к 2 раза в сутки без начального болюсного введения (максимально 75 мг для каждой из двух первых п/к инъекций) | 1 мг/кг п/к 1 раз в сутки без начального болюсного введения (максимально 100 мг для первой п/к инъекции) |
- При применении препарата с профилактической целью рекомендуется следующая коррекция режима дозирования (см. табл. 3).
- Таблица 3
| Обычный режим дозирования | Режим дозирования при тяжелой почечной недостаточности |
| 40 мг п/к 1 раз в сутки | 20 мг п/к 1 раз в сутки |
| 20 мг п/к 1 раз в сутки | 20 мг п/к 1 раз в сутки |
- Рекомендованная коррекция режима дозирования не применяется при гемодиализе.
- При легком (Cl креатинина 50–80 мл/мин) и умеренном (Cl креатинина 30–50 мл/мин) нарушении функции почек коррекция дозы не требуется, однако пациенты должны находиться под тщательным наблюдением врача.
- Пациенты с нарушениями функции печени. В связи с отсутствием клинических исследований, следует соблюдать осторожность при назначении эноксапарина натрия пациентам с нарушением функции печени.
- Инструкция по самостоятельному выполнению инъекции препарата Клексан® (предварительно заполненный шприц с защитной системой иглы)
- 1. Вымыть руки и участок кожи (место для инъекции), в который пациент будет вводить препарат, водой с мылом. Высушить.
- 2. Принять удобное положение сидя или лежа и расслабиться. Убедиться, что пациент хорошо видит место, в которое будет вводить препарат. Оптимально использовать кресло для отдыха, шезлонг или кровать, обложенную подушками для опоры.
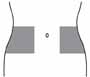
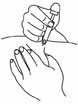
- 3. Выбрать место для проведения инъекции в правой или левой части живота. Это место должно находиться на расстоянии как минимум 5 см от пупка по направлению к бокам. Не выполнять самостоятельную инъекцию на расстоянии 5 см от пупка или вокруг имеющихся рубцов или кровоподтеков. Чередовать места инъекций в правой и левой частях живота в зависимости от того, куда был введен препарат в предыдущий раз (рис. 1).
-

- Рисунок 1.
- 4. Протереть место для инъекции тампоном, смоченным спиртом (рис. 2).
-

- Рисунок 2.
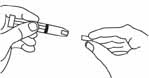
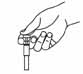
- 5. Осторожно снять колпачок с иглы шприца с препаратом Клексан®. Отложить колпачок. Шприц — предварительно заполнен и готов к использованию. Не нажимать на поршень для вытеснения пузырьков воздуха до введения иглы в место инъекции. Это может привести к потере препарата. После удаления колпачка не допускать прикосновения иглы к каким-либо предметам. Это необходимо для сохранения стерильности иглы (рис. 3).
-

- Рисунок 3.
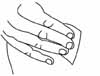
- 6. Удерживать шприц в руке, которой пациент пишет, так, как он держит карандаш, а другой рукой осторожно сжать протертое спиртом место для введения препарата, чтобы образовать складку кожи между большим и указательным пальцами. Удерживать кожную складку все время, пока вводится препарат (рис. 4).
-

- Рисунок 4.
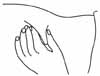
- 7. Удерживать шприц таким образом, чтобы игла была направлена вниз (вертикально под углом 90°). Ввсти иглу на всю ее длину в кожную складку (рис. 5).
-

- Рисунок 5.
- 8. Нажать пальцем на поршень. Это обеспечит введение препарата в подкожную жировую ткань живота. Удерживать кожную складку все время, пока пациент вводит препарат.
- 9. Извлечь иглу, потянув ее назад без отклонения от оси. Защитный механизм автоматически закроет иглу. Теперь можно прекратить удержание кожной складки. Система безопасности, обеспечивающая запуск защитного механизма, активируется только после введения всего содержимого шприца путем нажатия поршня на всю длину его хода.
- 10. В целях предотвращения образования кровоподтека, не растирать место инъекции после введения препарата.
- 11. Поместить использованный шприц с защитным механизмом в контейнер для острых предметов. Плотно закрыть контейнер крышкой и хранить его в недоступном для детей месте (рис. 6).
-

- Рисунок 6.
- При применении препарата строго придерживаться рекомендаций, представленных в данном описании, а также указаний врача или провизора. При возникновении вопросов обратиться к врачу или провизору.
- Видео-инструкцию по самостоятельному использованию пациентами шприца с защитным механизмом можно посмотреть, используя QR-код.
-

Применение при беременности и кормлении грудью
Сведений о том, что эноксапарин натрия проникает через плацентарный барьер во время II триместра беременности у человека, нет. Отсутствует соответствующая информация относительно I и III триместров беременности. Так как отсутствуют адекватные и хорошо контролируемые исследования у беременных женщин, а исследования на животных не всегда прогнозируют реакцию на введение эноксапарина натрия во время беременности у человека, применять его во время беременности следует только в тех случаях, когда имеется настоятельная необходимость его применения, установленная врачом.
Неизвестно, выделяется ли неизмененный эноксапарин натрия в грудное молоко у человека. Следует прекратить грудное вскармливание во время лечения матери препаратом Клексан®.
Клексан: Противопоказания
- повышенная чувствительность к эноксапарину натрия, гепарину или его производным, включая другие низкомолекулярные гепарины;
- активное большое кровотечение, а также состояния и заболевания, при которых имеется высокий риск развития кровотечения: угрожающий аборт, аневризма сосудов головного мозга или расслаивающаяся аневризма аорты (за исключением хирургического вмешательства), геморрагический инсульт, неконтролируемое кровотечение, тяжелая эноксапарин- и гепарин-индуцированная тромбоцитопения;
- не рекомендуется применение препарата Клексан® у беременных женщин с искусственными клапанами сердца ( недостаточность клинического опыта применения);
- возраст до 18 лет (эффективность и безопасность не установлены).
- С осторожностью: нарушения гемостаза (в т.ч. гемофилия, тромбоцитопения, гипокоагуляция, болезнь Виллебранда и др.), тяжелый васкулит; язвенная болезнь желудка или двенадцатиперстной кишки или другие эрозивно-язвенные поражения ЖКТ; недавно перенесенный ишемический инсульт; неконтролируемая тяжелая артериальная гипертония; диабетическая или геморрагическая ретинопатия; тяжелый сахарный диабет; недавно перенесенная или предполагаемая неврологическая или офтальмологическая операции; проведение спинальной или эпидуральной анестезии (потенциальная опасность развития гематомы), спинномозговая пункция (недавно перенесенная); недавние роды; эндокардит бактериальный (острый или подострый); перикардит или перикардиальный выпот; почечная и/или печеночная недостаточность; внутриматочная контрацепция (ВМК); тяжелая травма (особенно ЦНС), открытые раны на больших поверхностях; одновременный прием препаратов, оказывающих влияние на систему гемостаза.
- У компании отсутствуют данные по клиническому применению препарата Клексан ® при следующих заболеваниях: активный туберкулез, лучевая терапия (недавно перенесенная).
Клексан: Побочные действия
- Изучение побочных эффектов эноксапарина натрия проводилось у более чем 15000 пациентов, участвовавших в клинических исследованиях, из них у 1776 пациентов — при профилактике венозных тромбозов и эмболий при общехирургических и ортопедических операциях; у 1169 пациентов — при профилактике венозных тромбозов и эмболий у пациентов, находящихся на постельном режиме, вследствие острых терапевтических заболеваний; у 559 пациентов — при лечении тромбоза глубоких вен с тромбоэмболией легочной артерии или без тромбоэмболии легочной артерии; у 1578 пациентов — при лечении нестабильной стенокардии и инфаркта миокарда без зубца Q; у 10176 пациентов — при лечении инфаркта миокарда с подъемом сегмента ST.
- Режим введения эноксапарина натрия отличался в зависимости от показаний. При профилактике венозных тромбозов и эмболий при общехирургических и ортопедических операциях или у пациентов, находящихся на постельном режиме, вводилось 40 мг п/к один раз в сутки. При лечении тромбоза глубоких вен с тромбоэмболией легочной артерии или без нее, пациенты получали эноксапарин натрия из расчета 1 мг/кг п/к каждые 12 ч или 1,5 мг/кг п/к один раз в сутки. При лечении нестабильной стенокардии и инфаркта миокарда без зубца Q доза эноксапарина натрия составляла 1 мг/кг п/к каждые 12 ч, а в случае инфаркта миокарда с подъемом сегмента ST проводилось в/в болюсное введение 30 мг с последующим введением 1 мг/кг п/к каждые 12 ч.
- Нежелательные реакции были классифицированы по частоте возникновения следующим образом: очень частые (≥1/10); частые (≥1/100 — <1/10); нечастые (≥1/1000 — <1/100); редкие (≥1 /10000 — <1/1000); очень редкие (<1/10000), или частота неизвестна (по имеющимся данным частоту встречаемости нежелательной реакции оценить не представляется возможным). Нежелательные реакции, наблюдавшиеся после выхода препарата на рынок, были отнесены к параметру «частота неизвестна».
- Нарушения со стороны сосудов
- Кровотечения
- В клинических исследованиях кровотечения были наиболее часто встречающимися нежелательными реакциями. К ним относились большие кровотечения, наблюдавшиеся у 4,2% пациентов (кровотечение считалось большим, если оно сопровождалось снижением содержания гемоглобина на 2 г/л и более, требовало переливания 2 или более доз компонентов крови; а также если оно было забрюшинным или внутричерепным). Некоторые из этих случаев были летальными.
- Как и при применении других антикоагулянтов, при применении эноксапарина натрия возможно возникновение кровотечения, особенно при наличии факторов риска, способствующих развитию кровотечения, при проведении инвазивных процедур или применении препаратов, нарушающих гемостаз (см. «Особые указания» и «Взаимодействие»).
- При описании кровотечений знак «*» означает указание на следующие виды кровотечений: гематома, экхимозы (кроме развившихся в месте инъекции), раневые гематомы, гематурия, носовые кровотечения, желудочно-кишечные кровотечения (см. ниже).
- Очень часто — кровотечения* при профилактике венозных тромбозов у хирургических пациентов и лечении тромбоза глубоких вен с тромбоэмболией легочной артерии или без нее.
- Часто — кровотечения* при профилактике венозных тромбозов у пациентов, находящихся на постельном режиме, и лечении нестабильной стенокардии, инфаркта миокарда без зубца Q и инфаркта миокарда с подъемом сегмента ST.
- Нечасто — забрюшинные кровотечения и внутричерепные кровоизлияния у пациентов при лечении тромбоза глубоких вен с тромбоэмболией легочной артерии или без нее, а также при лечении инфаркта миокарда с подъемом сегмента ST.
- Редко — забрюшинные кровотечения при профилактике венозных тромбозов у хирургических пациентов и лечении нестабильной стенокардии и инфаркта миокарда без зубца Q.
- Тромбоцитопения и тромбоцитоз
- Очень часто — тромбоцитоз (количество тромбоцитов в периферической крови — >400·109/л) при профилактике венозных тромбозов у хирургических пациентов и лечении тромбоза глубоких вен с тромбоэмболией легочной артерии или без нее.
- Часто — тромбоцитоз при лечении пациентов с острым инфарктом миокарда с подъемом сегмента ST.
- Тромбоцитопения при профилактике венозных тромбозов у хирургических пациентов и лечении тромбоза глубоких вен с тромбоэмболией легочной артерии или без нее, а также при остром инфаркте миокарда с подъемом сегмента ST.
- Нечасто — тромбоцитопения при профилактике венозных тромбозов у пациентов, находящихся на постельном режиме, и при лечении нестабильной стенокардии и инфаркта миокарда без зубца Q.
- Очень редко — иммунно-аллергическая тромбоцитопения при лечении пациентов с острым инфарктом миокарда с подъемом сегмента ST.
- Другие клинически значимые нежелательные реакции вне зависимости от показаний
- Эти нежелательные реакции, представленные ниже, сгруппированы по системно-органным классам, даны с указанием определенной выше частоты их возникновения и в порядке уменьшения их тяжести.
- Со стороны иммунной системы: часто — аллергические реакции; редко — анафилактические и анафилактоидные реакции (см. также ниже подраздел Данные, полученные после выхода препарата на рынок).
- Со стороны печени и желчевыводящих путей: очень часто — повышение активности печеночных ферментов, главным образом повышение активности трансаминаз, более чем в три раза превышающее ВГН).
- Со стороны кожи и подкожных тканей: часто — крапивница, зуд, эритема; нечасто — буллезный дерматит.
- Общие расстройства и нарушения в месте инъекции: часто — гематома в месте инъекции, боль в месте инъекции, отек в месте инъекции, кровотечение, реакции повышенной чувствительности, воспаление, образование уплотнений в месте инъекции; нечасто — раздражение в месте инъекции, некроз кожи в месте инъекции.
- Лабораторные и инструментальные данные: редко — гиперкалиемия.
- Данные, полученные после выхода препарата на рынок
- Следующие нежелательные реакции отмечались во время постмаркетингового применения препарата Клексан®. Об этих побочных реакциях имелись спонтанные сообщения, и их частота была определена как «частота неизвестна» (не может быть установлена по имеющимся данным).
- Со стороны иммунной системы: анафилактические/анафилактоидные реакции, включая шок.
- Со стороны нервной системы: головная боль.
- Со стороны сосудов: при применении эноксапарина натрия на фоне спинальной/эпидуральной анестезии или спинальной пункции отмечались случаи развития спинальной гематомы (или нейроаксиальной гематомы). Эти реакции приводили к развитию неврологических нарушений различной степени тяжести, включая стойкий или необратимый паралич (см. «Особые указания»).
- Со стороны крови или лимфатической системы: геморрагическая анемия; случаи развития иммунно-аллергической тромбоцитопении с тромбозом (в некоторых случаях тромбоз осложнялся развитием инфаркта органов или ишемии конечностей — см. «Особые указания», подраздел Контроль количества тромбоцитов в периферической крови); эозинофилия.
- Со стороны кожи и подкожных тканей: в месте инъекции может развиться кожный васкулит, некроз кожи, которым обычно предшествует появление пурпуры или эритематозных папул (инфильтрированных и болезненных — в этих случаях терапию препаратом Клексан® следует прекратить); возможно образование твердых воспалительных узелков-инфильтратов в месте инъекций препарата, которые исчезают через несколько дней и не являются основанием для отмены препарата; алопеция.
- Со стороны печени и желчевыводящих путей: гепатоцеллюлярное поражение печени; холестатическое поражение печени.
- Со стороны скелетно-мышечной и соединительной ткани: остеопороз при длительной терапии (более 3 мес).
Передозировка
Симптомы: случайная передозировка Клексана® (при в/в, п/к или экстракорпоральном применении) может привести к геморрагическим осложнениям. При приеме внутрь даже больших доз всасывание препарата маловероятно.
Лечение: антикоагулянтные эффекты можно в основном нейтрализовать путем медленного в/в введения протамина сульфата, доза которого зависит от дозы введенного Клексана®. 1 мг протамина сульфата нейтрализует антикоагулянтную активность 1 мг Клексана®, если эноксапарин натрия вводился не более чем за 8 ч до введения протамина. 0,5 мг протамина нейтрализует антикоагулянтный эффект 1 мг Клексана®, если он вводился более 8 ч назад или при необходимости введения второй дозы протамина. Если же после введения эноксапарина натрия прошло 12 ч и более, введения протамина не требуется. Однако даже при введении больших доз протамина сульфата, анти-Ха активность Клексана® полностью не нейтрализуется (максимально — на 60%).
Взаимодействие
- Препарат Клексан® нельзя смешивать с другими препаратами.
- При одновременном применении с препаратами, влияющими на гемостаз (салицилатами системного действия, ацетилсалициловой кислотой, НПВС (включая кеторолак), декстраном с молекулярной массой 40 кДа, тиклопидином и клопидогрелом, системными ГКС, тромболитиками или антикоагулянтами, другими антитромбоцитарными препаратами (включая антагонисты гликопротеина IIb/IIIa), возрастает риск развития кровотечения (см. «Особые указания»).
Особые указания
- Общие
- Низкомолекулярные гепарины не являются взаимозаменяемыми, т.к. они различаются по процессу производства, молекулярной массе, специфической анти-Ха активности, единицам дозирования и режиму дозирования, с чем связаны различия в их фармакокинетике и биологической активности (антитромбиновая активность и взаимодействие с тромбоцитами).
- Поэтому требуется строго выполнять рекомендации по применению для каждого препарата, относящегося к классу низкомолекулярных гепаринов.
- Кровотечение
- Как и при применении других антикоагулянтов, при применении препарата Клексан® возможно развитие кровотечений любой локализации (см. «Побочные действия»). При развитии кровотечения необходимо найти его источник и проводить соответствующее лечение.
- Кровотечения у пациентов пожилого возраста. При применении препарата Клексан® в профилактических дозах у пациентов пожилого возраста не было выявлено тенденции к увеличению кровоточивости. При применении препарата в терапевтических дозах у пациентов пожилого возраста (особенно в возрасте >80 лет) существует повышенный риск развития кровотечений. Рекомендуется проведение тщательного наблюдения за состоянием таких пациентов (см. «Фармакокинетика» и «Способ применения и дозы», подраздел Пациенты пожилого возраста).
- Одновременное применение других препаратов, влияющих на гемостаз
- Рекомендуется, чтобы применение препаратов, способных нарушать гемостаз (салицилаты, в т.ч. ацетилсалициловая кислота, НПВС, включая кеторолак; декстран с молекулярной массой 40 кДа, тиклопидин, клопидогрел; ГКС, тромболитики, антикоагулянты, антиагреганты, включая антагонисты гликопротеиновых рецепторов IIb/IIIa) было прекращено до начала лечения эноксапарином натрия, за исключением случаев, когда их применение является строго показанным. Если показаны комбинации эноксапарина натрия с этими препаратами, то следует проводить тщательное клиническое наблюдение и мониторинг соответствующих лабораторных показателей.
- Почечная недостаточность
- У пациентов с нарушением функции почек существует риск развития кровотечения в результате увеличения системной экспозиции эноксапарина натрия.
- У пациентов с тяжелыми нарушениями функции почек (Cl креатинина менее 30 мл/мин) рекомендуется проводить коррекцию дозы, как при профилактическом, так и терапевтическом применении препарата. Хотя не требуется проводить коррекцию дозы у пациентов с легким и умеренным нарушением функции почек (Cl креатинина 30–50 или 50–80 мл/мин), рекомендуется проведение тщательного контроля состояния таких пациентов (см. «Фармакокинетика» и «Способ применения и дозы», подраздел Пациенты с почечной недостаточностью).
- Низкая масса тела
- Увеличение анти-Ха активности эноксапарина натрия при его профилактическом применении у женщин с массой тела менее 45 кг и у мужчин с массой тела менее 57 кг может приводить к повышенному риску развития кровотечений.
- Рекомендуется проведение тщательного контроля состояния таких пациентов.
- Пациенты с ожирением
- Пациенты с ожирением имеют повышенный риск развития тромбозов и эмболий. Безопасность и эффективность применения эноксапарина в профилактических дозах у пациентов с ожирением (ИМТ более 30 кг/м2) до конца не определена, и нет общего мнения по коррекции дозы. За этими пациентами следует внимательно наблюдать на предмет развития симптомов и признаков тромбозов и эмболий.
- Контроль количества тромбоцитов в периферической крови
- Риск развития антителоопосредованной гепарининдуцированной тромбоцитопении существует и при применении низкомолекулярных гепаринов. В случае возникновения тромбоцитопении она обычно развивается между 5-м и 21-м днями после начала терапии эноксапарином натрия. В связи с этим рекомендуется регулярно контролировать количество тромбоцитов в периферической крови до начала лечения препаратом Клексан® и во время его применения. При наличии подтвержденного значительного снижения количества тромбоцитов (на 30–50% по сравнению с исходным показателем) необходимо немедленно отменить эноксапарин натрия и перевести пациента на другую терапию.
- Спинальная/эпидуральная анестезия
- Описаны случаи возникновения нейроаксиальных гематом при применении препарата Клексан® при одновременном проведении спинальной/эпидуральной анестезии с развитием длительно существующего или необратимого паралича. Риск возникновения этих явлений снижается при применении препарата в дозе 40 мг или ниже.
- Риск повышается при применении более высоких доз препарата Клексан®, а также при использовании постоянных катетеров после операции, или при одновременном применении дополнительных препаратов, влияющих на гемостаз, таких как НПВС (см. «Взаимодействие»). Риск также повышается при травматически проведенной или повторной спинномозговой пункции или у пациентов, имеющих в анамнезе указания на перенесенные операции в области позвоночника или деформацию позвоночника. Для снижения возможного риска кровотечения, связанного с применением эноксапарина натрия и проведением эпидуральной или спинальной анестезии/анальгезии необходимо учитывать фармакокинетический профиль препарата (см. «Фармакокинетика»). Установку или удаление катетера лучше проводить при низком антикоагулянтном эффекте эноксапарина натрия, однако точное время для достижения достаточного снижения антикоагулянтного эффекта у разных пациентов неизвестно.
- Установка или удаление катетера должны проводиться спустя, как минимум, 12 ч после введения более низких доз препарата Клексан® (20 мг 1 раз в сутки, 30 мг 1 или 2 раза в сутки, 40 мг 1 раз в сутки) и, как минимум, через 24 ч после введения более высоких доз препарата Клексан® (0,75 мг/кг 2 раза в сутки, 1 мг/кг 2 раза в сутки, 1,5 мг/кг 1 раз в сутки). В эти временные точки все еще продолжает выявляться анти-Ха активность препарата, и отсрочки по времени не являются гарантией того, что развития нейроаксиальной гематомы удастся избежать. Пациентам, получающим эноксапарин натрия в дозах 0,75 мг/кг 2 раза в сутки или 1 мг/кг 2 раза в сутки, при таком (двукратном в течение суток) режиме дозирования, не следует вводить 2-ю дозу, для того чтобы увеличить интервал перед установкой или заменой катетера.
- Точно также следует рассмотреть вопрос о возможности отсрочки введения следующей дозы препарата, как минимум, на 4 ч, исходя из оценки соотношения польза/риск (риск развития тромбоза и кровотечений при проведении процедуры, с учетом наличия у пациентов факторов риска). Однако дать четкие рекомендации по времени введения следующей дозы эноксапарина натрия после удаления катетера не представляется возможным. Следует учитывать, что у пациентов с Cl креатинина менее 30 мл/мин выведение эноксапарина натрия замедляется. Поэтому у данной категории пациентов следует рассмотреть вопрос об удвоении времени от момента удаления катетера: как минимум, 24 ч для более низких доз эноксапарина натрия (30 мг 1 раз в сутки) и, как минимум, 48 ч для более высоких доз (1 мг/кг/сут).
- Если по назначению врача применяется антикоагулянтная терапия во время проведения эпидуральной/спинальной анестезии или люмбальной пункции, необходимо постоянное наблюдение за пациентом для выявления любых неврологических симптомов, таких как боли в спине, нарушение сенсорных и моторных функций (онемение или слабость в нижних конечностях), нарушение функции кишечника и/или мочевого пузыря. Пациента необходимо проинструктировать о необходимости немедленного информирования врача при возникновении вышеописанных симптомов. При подозрении на симптомы, характерные для гематомы спинного мозга, необходимы срочная диагностика и лечение, включая, при необходимости, декомпрессию спинного мозга.
- Гепарининдуцированная тромбоцитопения
- С особой осторожностью препарат Клексан® следует применять у пациентов, в анамнезе которых имеются сведения о гепарининдуцированной тромбоцитопении в сочетании с тромбозом или без него.
- Риск гепарининдуцированной тромбоцитопении может сохраняться в течение нескольких лет. Если анамнестически предполагается наличие гепарининдуцированной тромбоцитопении, то тесты на агрегацию тромбоцитов in vitro имеют ограниченное значение при прогнозировании риска ее развития. Решение о применении препарата Клексан® в таком случае можно принимать только после консультации с соответствующим специалистом.
- Чрескожная коронарная ангиопластика
- С целью минимизации риска кровотечения, связанного с инвазивной сосудистой инструментальной манипуляцией, при лечении нестабильной стенокардии и инфаркта миокарда без зубца Q и острого инфаркта миокарда с подъемом сегмента ST, эти процедуры следует проводить в интервалах между введением препарата Клексан®. Это необходимо для того, чтобы достигнуть гемостаза после проведения чрескожного коронарного вмешательства. При использовании закрывающего устройства интродьюсер бедренной артерии может быть удален немедленно. При применении мануальной компрессии интродьюсер бедренной артерии следует удалить через 6 ч после последней в/в или п/к инъекции эноксапарина натрия. Если лечение эноксапарином натрия продолжается, то следующую дозу следует вводить не ранее, чем через 6–8 ч после удаления интродьюсера бедренной артерии. Необходимо следить за местом введения интродьюсера, чтобы своевременно выявить признаки кровотечения и образования гематомы.
- Пациенты с механическими искусственными клапанами сердца
- Применение препарата Клексан® для профилактики тромбообразования у пациентов с механическими искусственными клапанами сердца изучено недостаточно. Имеются отдельные сообщения о развитии тромбоза клапанов сердца у пациентов с механическими искусственными клапанами сердца на фоне терапии эноксапарином натрия для профилактики тромбообразования. Оценка этих сообщений ограничена из-за наличия конкурирующих факторов, способствующих развитию тромбоза искусственных клапанов сердца, включая основное заболевание, и из-за недостаточности клинических данных.
- Беременные женщины с механическими искусственными клапанами сердца. Применение препарата Клексан® для профилактики тромбообразования у беременных женщин с механическими искусственными клапанами сердца изучено недостаточно. В клиническом исследовании беременных женщин с механическими искусственными клапанами сердца при применении эноксапарина натрия в дозе 1 мг/кг два раза в сутки для уменьшения риска тромбозов и эмболий, у 2 из 8 женщин образовался тромб, приведший к блокированию клапанов сердца и смерти матери и плода. Имеются отдельные постмаркетинговые сообщения о тромбозе клапанов сердца у беременных женщин с механическими искусственными клапанами сердца, получавших лечение эноксапарином для профилактики тромбообразования. Беременные женщины с механическими искусственными клапанами сердца имеют высокий риск развития тромбоза и эмболии.
- Лабораторные тесты
- В дозах, применяемых для профилактики тромбоэмболических осложнений, препарат Клексан® существенно не влияет на время кровотечения и показатели свертывания крови, а также на агрегацию тромбоцитов или на связывание их с фибриногеном.
- При повышении дозы может удлиняться АЧТВ и активированное время свертывания крови. Увеличение АЧТВ и активированного времени свертывания не находятся в прямой линейной зависимости от увеличения антикоагулянтной активности препарата, поэтому нет необходимости в их мониторинге.
- Профилактика венозных тромбозов и эмболий у пациентов с острыми терапевтическими заболеваниями, находящихся на постельном режиме
- В случае развития острой инфекции, острых ревматических состояний профилактическое применение эноксапарина натрия оправдано только, если вышеперечисленные состояния сочетаются с одним из нижеперечисленных факторов риска венозного тромбообразования: возраст более 75 лет; злокачественные новообразования; тромбозы и эмболии в анамнезе; ожирение; гормональная терапия; сердечная недостаточность; хроническая дыхательная недостаточность.
- Влияние на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. Не влияет.
Форма выпуска
Раствор для инъекций, 2000 анти-Ха МЕ/ 0,2 мл; 4000 анти-Ха МЕ/0,4 мл; 6000 анти-Ха МЕ/0,6 мл; 8000 анти-ХаМЕ/0,8 мл; 10000 анти-Ха МЕ/1 мл.
1 вид упаковки: 4000 анти-Ха МЕ/0,4 мл. По 0,2 мл или 0,4 мл или 0,6 мл или 0,8 мл или 1 мл раствора препарата в стеклянном шприце (тип I) соответственно.По 2 шприца в блистере. По 1 или 5 блистеров в картонную пачку.
2 вид упаковки: По 0,2 мл или 0,4 мл или 0,6 мл или 0,8 мл или 1 мл раствора препарата в стеклянном шприце (тип I) с защитной системой иглы соответственно. По 2 шприца в блистере. По 1 или 5 блистеров в картонную пачку.
Условия отпуска
По рецепту.
Производитель
1. Sanofi Winthrop Industrie, France. 180, rue Jean Jaures, 94702 Maisons-Alfort Cedex, France.
2. Sanofi Winthrop Industrie, France. Boulevard Industriel, Zone Industrielle, 76580 Le Trait, France.
Юридическое лицо, на имя которого выдано регистрационное удостоверение. Санофи-Авентис Франс, Франция.
Претензии потребителей направлять по адресу в России: 125009, Москва, ул. Тверская, 22.
Тел.: (495) 721-14-00; факс: (495) 721-14-11.
В случае упаковки препарата на ЗАО «Санофи-Авентис Восток», Россия, претензии потребителей направлять по адресу: 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Тел./факс: (486) 2-44-00-55.
В случае упаковки препарата на ОАО «Фармстандарт-УфаВИТА», Россия, претензии потребителей направлять по адресу: 125009, Москва, ул. Тверская, 22.
Тел.: (495) 721-14-00; факс: (495) 721-14-11.
Характеристики
Сертификаты Клексан 2000 анти-Ха МЕ/0.2 мл, раствор для инъекций, 0.2 мл, 10 шт.




Аналоги Клексан





Отзывы о Клексан



Дистанционная торговля лекарственными препаратами осуществляется исключительно аптечными организациями, имеющими действующую лицензию на фармацевтическую деятельность, а также разрешение на дистанционную торговлю лекарственными препаратами. Дистанционная торговля рецептурными лекарственными препаратами, наркотическими и психотропными, а также спиртосодержащими лекарственными препаратами запрещена действующим законодательством РФ и не осуществляется.
На информационном ресурсе применяются рекомендательные технологии .